エレメンタッチって何?
従来の周期表との違いは?立体にすると見えてくる元素の世界
エレメンタッチ(Elementouh)とは、元素(element)に触れる(touch)という意味と、「立っている」という意味をかけて造った名称です。周期表を立体で捉えたことで、元素の性質や規則性がより正確に表現され、目で見て理解できる元素の世界が広がりました。
![]() YouTubeで3Dのエレメンタッチ解説をご覧いただけます。
YouTubeで3Dのエレメンタッチ解説をご覧いただけます。
元素の周期表の歴史
※画像をクリックすると拡大版がご覧いただけます。
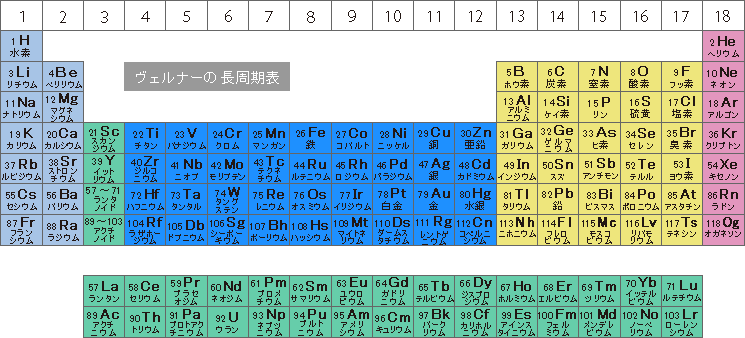
たとえば、20Caと48Cd、4族の22Tiと50Snは、長周期表では、一見、無関係の位置にあります。また、下の別表の右端にある71Luは39Yや57Laとよく似ていますが、長周期表ではそれが明らかではありません。エレメンタッチではCaとCd、TiとSn、そしてYとLaとLuがそれぞれ縦一列に並ぶようになりました。
エレメンタッチの特徴
長周期表は最も完成度の高い周期表といえますが、それでもまだ完璧ではありません。エレメンタッチは元素記号をらせん状に並べた新しい周期表で、長周期表の問題点を解消することに成功しました。
1.すべての元素が番号順に綺麗にならんでる!
元素の正体は大きさが1億分の1㎝くらいの小さな粒で、この粒子は原子とよばれています。原子の中心には原子核と呼ばれる芯があり、その周りをいくつもの電子が回っています。電子の回る勢い(角運動量)の違いによって、s、p、d、fの4種類の軌道があります。そして、一番外側を回る電子(最外殻電子)の軌道が、それぞれの元素の性質を決めるのに重要な役割を果たします。
さて、長周期表の最初の問題点は、元素が切れ目なく並んでいないことです。マグネシウム12Mgとアルミニウム13Alという性質も似ており、原子番号からも本来隣同士に並ぶべき元素の感覚が随分空いています。(元素記号の左下付の数字は原子番号と呼ばれるもので、原子核に含まれる陽子の数を表します。)これは4行目以下に3族から12族までのd電子系遷移金属と呼ばれる元素があるために生じた不合理です。また長周期表には、下の小さな表にはみ出した元素がたくさんあります。
d電子系遷移金属元素(スカンジウム21Scから亜鉛30Znなど)は最外殻にd電子を持っており、これらは周期表の中央に組み込まれています。ところが、f電子系遷移金属元素jは下に別表扱いになってしまうため、原子番号56のバリウムと72のハフニウムとの間で不連続性が生じています。長周期表が作られた頃とは異なり、現在ではf電子系遷移金属元素であるランタノイド元素達は、ハイテク産業を支える磁性材料をはじめとして、極めて需要で身近な元素となっており、もはや別表扱いにしておくべきではありません。 エレメンタッチでは、原子番号1の水素から始まり、すべての元素が原子記号順に切れ目なくらせんを描いて並んでいます。
2.原子核のまわりの電子軌道も表現している!

3.化合物中での元素の性質も一目でわかる!
たとえば、20Caを48Cdに置き換えることで新超伝導体が発見されました。いずれも+2価のイオンになりやすく、これらの元素が属する2族と12族は1985年以前にはそれぞれ2A族、2B族と呼ばれていました。しかも、もともとメンデレーフの短周期表では、これらは同一の列のなかにあったのです。これは金属元素が酸化物を作るときの、最も安定な電子価数を表現したからでした。この他にも、ともに+4価の非磁性イオンになりやすい4族の22Tiと14族の50Snも、長周期表では、一見、無関係の位置にあります。
また原子番号71のルテチウム71Luは3価で非磁性イオンとなる点で、ランタノイドを含む希土類元素のうち、39Yや57Laとよく似ていますが、長周期表ではそれが明らかではありませんでした。
これらの問題に対して、エレメンタッチでは、2価、3価、4価になりやすい元素がそれぞれ縦に一列に並ぶようになりました。同時に、典型元素と遷移金属元素の違いは、色の違いで区別して表現しています。上の例では、CaとCd、TiとSn、そしてYとLaとLuがそれぞれ縦一列に並ぶようになりました(写真下)。

2価の元素列
CaとCdが同列に並んでいます
.gif)
3価の元素列
Y, La, Luが同じ列に

4価の元素列
TiとSnが同じ列に
専門誌での解説(PDFリンク)
『金属』
2005年Vol. 74



